
骨発育疾患研究部門
研究内容
1. リン恒常性維持分子機構とその破綻による疾患に関する研究
リンは生命維持に必須の元素であり、細胞構造保全、遺伝情報の保持と伝達、エネルギー代謝、シグナル伝達など、ほとんど全ての生物学的プロセスを担います。また、脊椎動物においては骨格の形成と石灰化にも関与します。胎児期から小児期にかけては、成長過程にある骨および軟部組織に多量のリンが付加される必要があり、高いリン需要を反映して血清リン値は成人に比し高値に維持されています。リン恒常性の破綻は、くる病などの種々の代謝性骨疾患や成長障害をはじめ、筋症状や神経症状を含めた多彩な症状を来します。一方、慢性腎臓病(chronic kidney disease; CKD)におけるリンの過剰負荷は心血管イベントや腫瘍の発生、炎症などを増加させ、死亡リスクにつながるため、血清リン値のコントロールは重要な治療目標の一つです。そこで、当部門においては、リン恒常性維持機構および種々のリン代謝異常症の分子病態の解明を主要な研究テーマの一つとしています。
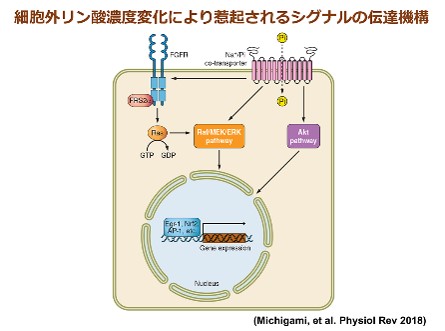
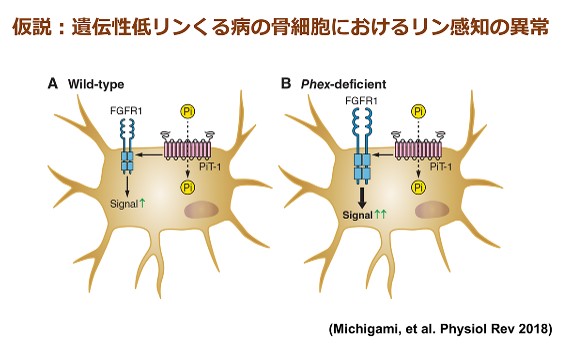
リンの恒常性には腎臓、腸管、骨、副甲状腺の臓器連関と種々のナトリウム/リン酸 (Na+/Pi)共輸送担体が重要な役割を果たしており、FGF23、1,25水酸化ビタミンD、PTHなどのホルモンがこれらの制御に関与しています。中でも中心的な役割を担うFGF23は骨で産生され、腎臓の近位尿細管におけるIIa型及びIIc型Na+/Pi共輸送担体の発現を抑制してリン酸排泄を増加させるとともに、1,25水酸化ビタミンDの産生を抑制して腸管でのリンの吸収を低下させます。FGF23の主たる産生細胞である骨細胞は、骨芽細胞が最終分化に至り石灰化した骨基質に埋没した細胞であり、近年、骨代謝における重要性が注目されています。骨細胞には、FGF23以外にも、X連鎖性遺伝性低リン血症性くる病 (XLH) の責任分子であるPHEXや、常染色体潜性遺伝性低リン血症性くる病1型 (ARHR1) の責任分子であるDMP1などが高発現しており、このことから骨細胞はリン代謝調節の司令塔と位置付けられます。これまで当部門においては、XLHモデルマウスにおける骨細胞機能異常、FGF23の発現・分泌の制御機構、軟骨や胎盤におけるFGF23の作用、時計遺伝子によるミネラル代謝制御などについて研究を行ってきました。また、哺乳類におけるリン感知機構は明らかになっていないところから、細胞外無機リン酸濃度の変化により惹起されるシグナルの伝達機構について解析し、III 型Na+/Pi共輸送担体やFGF受容体、MEK/ERK経路の関与を明らかにしてきました。本研究課題では、これらの研究成果を発展させ、リンの過不足の感知から骨細胞におけるリン代謝調節因子群の制御に至る一連の分子機序を明らかにしたいと考えています。さらに、低リン血症性くる病、慢性腎臓病など種々のリン代謝異常症の病態形成機構の解明にも取り組み、診断や治療への応用をめざしています。
関連文献
[1] Yamazaki M, Kawai M, Kinoshita S, Tachikawa K, Nakanishi T, Ozono K, Michigam T. Clonal osteoblastic cell lines with CRISPR/Cas9-mediated ablation of Pit1 or Pit2 show enhanced mineralization despite reduced osteogenic gene expression. Bone 2021; 151:116036.
[2] Kawai M, Kinoshita S, Ozono K, Michigami T. Lack of PTEN in osteocytes increases circulating phosphate concentrations by decreasing intact fibroblast growth factor 23 levels. Sci Rep 2020; 10: 21501.
[3] Kawai M, Kinoshita S, Yamazaki M, Yamamoto K, Rozen CJ, Shimba S, Ozono K, Michigami T. Intestinal clock system regulates skeletal homeostasis. JCI Insight 2019; 4: pii121798.
[4] Michigami T, Kawai M, Yamazaki M, Ozono K. Phosphate as a signaling molecule and its sensing mechanism. Physiol Rev 2018; 98: 2317–2348.
[5] Kawai M, Kinoshita S, Ozono K, Michigami T. Inorganic phosphate activates the AKT/mTORC1 pathway and shortens the life span of an a-Klotho-deficient model. J Am Soc Nephrol 2016; 27: 2810–2824.
[6] Yamazaki M, Kawai M, Miyagawa K, Ohata Y, Tachikawa K, Kinoshita S, Nishino J, Ozono K, Michigami T. Interleukin-1-induced acute bone resorption facilitates the secretion of fibroblast growth factor 23 into the circulation. J Bone Miner Metab 2015; 33: 342–354.
[7] Ohata Y, Yamazaki M, Kawai M, Tsugawa N, Tachikawa K, Koinuma T, Miyagawa K, Kimoto A, Nakayama M, Namba N, Yamamoto H, Okano T, Ozono K, Michigami T. Elevated fibroblast growth factor 23 exerts its effects on placenta and regulates vitamin D metabolism in pregnancy of Hyp mice. J Bone Miner Res 2014; 29: 1627–1638.
[8] Kawai M, Kinoshita S, Shimba S, Ozono K, Michigami T. Sympathetic activation induces skeletal Fgf23 expression in a circadian rhythm-dependent manner. J Biol Chem 2014; 289: 1457–1466.
[9] Miyagawa K, Yamazaki M, Kawai M, Nishino J, Koshimizu T, Ohata Y, Tachikawa K, Mikuni-Takagaki Y, Kogo M, Ozono K, Michigami T. Dysregulated gene expression in the primary osteoblasts and osteocytes isolated from hypophosphatemic Hyp mice. PLoS One 2014; 9: e93840.
[10] Kawai M, Kinoshita S, Kimoto A, Hasegawa Y, Miyagawa K, Yamazaki M, Ohata Y, Ozono K, Michigami T. FGF23 suppresses chondrocyte proliferation in the presence of soluble a-Klotho both in Vitro and in Vivo. J Biol Chem 2013; 288: 2414–2427.
[11] Kimata M, Michigami T, Tachikawa K, Okada T, Koshimizu T, Yamazaki M, Kogo M, Ozono K. Signaling of inorganic extracellular phosphate up-regulates cyclin D1 expression in proliferating chondrocytes via the type III Na+/Pi cotransporter Pit-1 and Raf/MEK/ERK pathway. Bone 2010; 47: 938–947.
[12] Yamazaki M, Ozono K, Okada T, Tachikawa K, Kondou H, Ohata Y, Michigami T. Both FGF23 and extracellular phosphate activate Raf/MEK/ERK pathway via FGF receptors in HEK293 cells. J Cell Biochem 2010; 111: 1210–1221.
2. 骨・軟骨の分化成熟機構と関連疾患の分子病態に関する研究
胎児期から小児期にかけて身体は急速な発育を遂げますが、その中心的役割を担うのは骨格の形成と成長です。骨の長軸成長を規定するのは内軟骨性骨形成であり、軟骨細胞の増殖や分化の障害は骨格の形成や成長の異常をもたらします。また、骨では常に骨芽細胞による骨形成と破骨細胞による骨吸収が起こっており、骨形成と骨吸収の不均衡は骨量の異常を引き起こします。骨成長障害や骨量低下は病的小児に共通して認められる臨床課題であり、遺伝的要因に加え、疾病特異的な要因や、不適切な栄養摂取、胎児期の母体環境等のさまざまな環境要因が原因となります。本課題においては、骨格の形成や維持の制御機構および関連疾患の発症機序に関する研究を通じて、小児の健全な骨発育に貢献することを目的としています。これまで、骨格の形成や維持に関わる種々のシグナル経路について解析を行い、WntやIGF、FGFなどの液性因子のシグナルや細胞外基質からのシグナル、細胞外無機リン酸による制御などについて報告してきました。
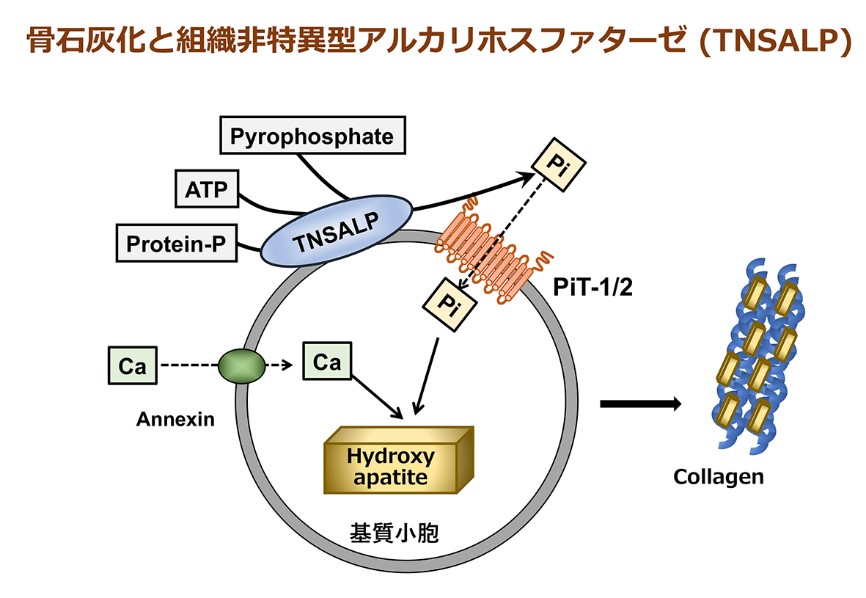
骨系統疾患の研究にも取り組んできました。骨系統疾患とは、先天性にあるいは発育過程で骨や軟骨に顕著な病変や形態異常を呈する疾患群の総称であり、個々の疾患単位としては稀なものも存在しますが、患者の総数としては少なくありません。従来、骨系統疾患は「根本的な治療法のない病気」の代表格であり、対症的な内科的、外科的治療のみがなされてきました。しかしながら、近年、多くの骨系統疾患で責任遺伝子が明らかになり、その分子病態を詳細に解析することにより、より病態に即した治療の開発が可能となってきています。また、骨系統疾患の病態への関与が明らかとなった分子やシグナル伝達経路は、当該の疾患のみならず、骨粗鬆症やリウマチなど、より頻度が高い骨軟骨疾患の治療標的としても期待されます。最近では、C型ナトリウム利尿ペプチド(CNP)に対する受容体であるナトリウム利尿ペプチド受容体B (NPRB)の機能獲得型変異による過成長性疾患のモデルマウスを解析し、CNP-NPRBシグナルによる軟骨伸長作用の新たな分子機序を明らかにしました。また、低ホスファターゼ症 (Hypophosphatasia: HPP)に関しても長年にわたり研究を行い、診療の向上に貢献してきました。HPP は組織非特異型アルカリホスファターゼ遺伝子 (ALPL) の機能喪失変異に基づき、骨石灰化障害や乳歯早期脱落など多彩な症状を呈する疾患です。従来、発症時期及び重症度により周産期致死型、乳児型、小児型、成人型、歯限局型の5病型に分類されてきましたが、当部門では新たな病型として周産期良性型の存在を明らかにしました。
また、多くのHPP患者の解析から、日本人においては周産期重症型が約半数を占め、海外では稀な周産期良性型が二番目に多いこと、日本人に特有の2つの変異の頻度が高いことがそれぞれ周産期重症型、周産期良性型症例が多い原因となっていることを報告しました。HPPの診療ガイドラインの策定にも貢献し、2020年にはHPPに関する医療情報ウェブサイトを立ち上げました (URL: https://hpp-keihatsu.jp)・
今後も、iPS細胞やCRISPR/Cas9によるゲノム編集、動物モデルなどを活用しながら、種々の骨軟骨疾患の病態解明を進め、診断・治療の向上に役立てたいと考えています。
関連文献
[1] Michigami T, Tachikawa K, Yamazaki M, Kawai M, Kubota T, Ozono K. Hypophosphatasia in Japan: ALPL mutation analysis in 98 unrelated patients. Calcif Tissue Int 2020; 106: 221–231.
[2] Yamamoto K, Kawai M, Yamazaki M, Tachikawa K, Kubota T, Ozono K, Michigami T. CREB activation in hypertrophic chondrocytes is involved in the skeletal overgrowth in epiphyseal chondrodysplasia Miura type caused by activating mutations of natriuretic peptide receptor B. Hum Mol Genet 2019; 28: 1183–1198.
[3] Nishino J, Yamazaki M, Kawai M, Tachikawa K, Yamamoto K, Miyagawa K, Kogo M, Ozono K, Michigami T. Extracellular phosphate induces the expression of dentin matrix protein 1 through the FGF receptor in osteoblasts. J Cell Biochem 2017; 118:1151–1163.
[4] Michigami T. Regulatory mechanisms for the development of growth plate cartilage. Cell Mol Life Sci 2013; 70: 4213–4221.
[5] Koshimizu T, Kawai M, Kondou H, Tachikawa K, Sakai N, Ozono K, Michigami T. Vinculin functions as a regulator of chondrogenesis. J Biol Chem 2012; 287: 15760–15775.
[6] Kubota T, Michigami T, Sakaguchi N, Kokubu C, Suzuki A, Namba N, Sakai N, Nakajima S, Imai K, Ozono K. Lrp6 hypomorphic mutation affects bone mass through bone resorption in mice and impairs interaction with Mesd. J Bone Miner Res 2008; 23: 1661–1671.
[7] Suzuki A, Ozono K, Kubota T, Kondou H, Tachikawa K, Michigami T. PTH/cAMP/PKA signaling facilitates canonical Wnt signaling via inactivation of glycogen synthase kinase-3b in osteoblastic Saos-2 cells. J Cell Biochem 2008; 104: 304–317.
[8] Uchihashi T, Kimata M, Tachikawa K, Koshimizu T, Okada T, Ihara-Watanabe M, Sakai N, Kogo M, Ozono K, Michigami T. Involvement of nuclear factor I transcription/replication factor in the early stage of chondrocytic differentiation. Bone 2007; 41: 1025–1035.


 English
English




